Rutinar
Rutinar ved oppstart av kliniske studiar i Helse Førde
Denne rutina gjeld ved kliniske behandlingsstudiar (multisenterstudiar) der Helse Førde HF er samarbeidande/deltakande institusjon.

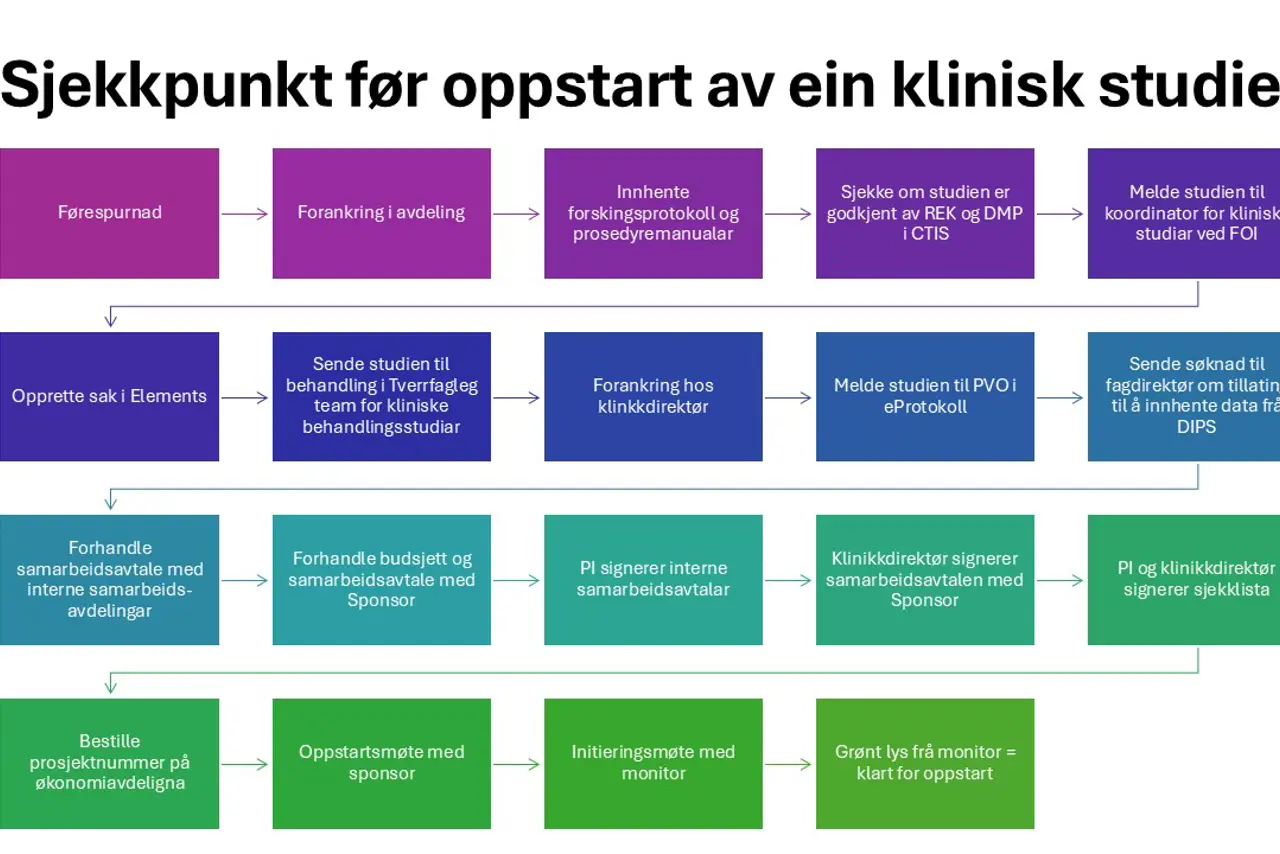
Her får du som lokal prosjektleiar ei oversikt over kva som må vere på plass frå du mottar ein førespurnad om du er interressert i å delta i ein ny studie, og fram til alt er klart til å starte å inkludere pasientar i studien.
For meir detaljar viser vi til Framgangsmåte for forsking i Helse Førde.
Definisjonar:
Klinisk utprøving av legemidlar:
- Einkvar systematisk studie av legemidlar til menneske i den hensikt å skaffe til veie eller etterprøve kunnskap om legemidlane sine effektar eller påverknader av fysiologisk funksjon, interaksjonar, biverknader, opptak, fordeling, metabolisme og utskiljing, eller for å studere deira terapeutiske verdi.
Oppdragsstudiar:
- betyr industri-initierte studiar som er finansiert av industrien (firma). Firmaet er studiens sponsor iht GCP, det vil seie at firma er ansvarlig for initiering og gjennomføring av studien.
Bidragsstudiar
- betyr sjukehus-initierte studiar som mottek bidrag frå industrien (firma) i form av finansiell støtte, medikament, medisinske råd eller liknande. Sjukehus/utprøvar er sponsor iht GCP, det vil seie at sjukehuset er ansvarlig for initiering og gjennomføring av studien.
For andre definisjonar, sjå Omgrep og definisjonar
Før eit firma bestemmer kva for land og helseføretak dei ynskjer å samarbeide med i ein ny klinisk behandlingsstudie, er det vanlig å gjennomføre ein såkalla feasibility, dvs. at firmaet sender ut førespurnad via sin lokale representant til potensielle utprøvarar for å høyre om studien kan vere aktuell for dei. Mange førespurnader kjem òg via NorTrials feasibilityportal og NorTrails sentra.
Spørsmål som må avklarast kan t.d. vere:
- Er pasientgrunnlaget til stades?
- Har avdelinga konkurrerande studiar?
- Har sjukehuset ressursar (personell, utstyr) til å gjennomføre studien?
- Er logistikken i studien gjennomfør bar? (t.d. lab prøver som skal takast utanom vanlig opningstid).
- Har serviceavdelingane kapasitet og ressursar til å følgje opp studien?
Feasibilityhenvendelsar har ofte kort svarfrist, og for å kome i betraktning er det viktig å svare innan fristen.
Deretter vurderer firmaet kva for land og helseføretak dei ynskjer å samarbeide med i den aktuelle studien. Dei som blir valt ut mottar ein forpliktande forespørsel på om dei ynskjer å delta i studien.
Øvste ansvarleg for forskingsverksemd i Helse Førde er administrerande direktør (AD). Klinikkdirektørane i Helse Førde utøver dette ansvaret, og det er dei som skal forankre prosjektet i sjukehuset. Det er kun klinikkdirektør som kan gje klarsignal til at studien kan starte. Det er klinikkdirektør som skal signere samarbeidsavtalen på vegne av Helse Førde.
Lokal hovedutprøvar (PI) er ansvarlig for å forankre studien i eigen klinikk.
Framgangsmåte:
- Forankre i avdleinga ved å diskutere med dei andre legane, studiepersonell og næraste leiing om dette er ein studie ein yndkjer å delta i og om ein har tilstrekkelig ressursar i avdelinga.
- Melde studien til "Tverrfagleg team for kliniske behandlingsstudiar" ved leiar Knut Erik Folland på epost: knut.erik.folland@helse-forde.no. Legg ved forskingsprotokoll, prosedyremanualar og samarbeidsavtalen.
- "Tverrfagleg team for kliniske behandlingsstudiar" sender si tilråding til klinikdirektør som gir endelig tilråding.
Melding om studien skal snarast sendast til:
Koordinator for kliniske studiar, Anne Solveig Tråseth anne.solveig.traseth@helse-forde.no eller til kliniske.studier@helse-forde.no
Dette kan koordinator for kliniske studiar kan bidra med:
- Rådgjeving/ opplæring til lokal hovedutprøvar (PI)
- Rådgjeving/ opplæring til forskings-/studiesjukepleiar
- Bistå PI ved inngåing av interne samarbeidsavtalar, utarbeiding av budsjett, forhandle kontrakt/samarbeidsavtalen med sponsor, arkivering i Elements m.m.
- Organisere og delta på informasjons-, planleggings- og samarbeidsmøter, internt og eksternt
- Koordinere signering av samarbeidsavtalen og sjekklista
Kontaktpersonar ved Seksjon for Forsking og Innovasjon:
Forskingsleiar Marit Solheim: marit.solheim@helse-forde.no
Koordinator for kliniske studiar Anne Solveig Tråseth: anne.solveig.traseth@helse-forde.no
Forskingskoordinator John Roger Andersen: john.andersen@helse-forde.no
Forskingskoordinator Runar Tengel Hovland: runar.tengel.hovland@helse-forde.no
Søknad til REK og DMP via CTIS
For klinisk utprøving av legemiddel:
Etter ny forordning, gjeldande frå 31.01.22, skal Sponsor søkje REK og DMP via den europeiske databasen CITIS (Clinical Trial Information System).
All korrespondanse om søknaden, inkl. svar på søknad, får ein i CTIS (dvs ein får ikkje epost), ein må difor logge inn dagleg og sjekke om det er komt spørsmål eller svar. Det er korte svarfristar i CTIS.
Pasientinformasjon og samtykke
Samtykkeskrivet skal vere på Norsk. Det er sponsor sitt ansvar å utforme samtykket, men prosjektleiar vil ofte få spørsmål om å bidra til dette. Pass på å bruke rett mal for samtykkeskriv.
NorTrials koordinerende enhet ved Oslo universitetssykehus kan evt hjelpe til med dette. Gje beskjed til koordinator for kliniske studiar, Anne Solveig Tråseth, dersom dette er aktuelt.
For klinisk utprøving av medisinsk utstyr:
Sponsor har ansvar for søknad til REK og DMP
Eit forskingsprosjekt kan involvere eller ikkje involvere personopplysingar. I Helse Førde skal alle prosjekt (med eller utan persondata) meldast til verksemda i det elektroniske skjemaet eProtokoll.
I eProtokoll skal ein laste opp protokoll, kopi av REK-søknad, samtykkeskjema og andre relevante vedlegg.
Dersom det skal nyttast/utleverast opplysningar frå elektronisk journal (EPJ/DIPS) i Helse Førde skal søknad sendast og godkjennast av fagdirektør.
Søknadsskjema: Søknad om tillating til inn henting av data frå elektronisk pasientjournal og pasientadministrative system
Det er viktig å vere tidlig ute med førespurnad til samarbeidsavdelingane.
Førespurnadane må vere gjennomarbeida slik at det er tydeleg kva som må gjerast; kor mange studiebesøk per pasient, når skal studien starte, kor lenge studien varer og kor mange pasientar ein planlegg å rekruttere inn i studien. Legg ved forskingsprotokoll og prosedyremanualar.
Skriftelige avtalar skal arkiverast Elements.
Du kan nytte disse skjemaene når du skal søkje om samarbeid:
Førespurnad om internt samarbeid i klinisk studie
Søknad om laboratorietenester
Søknad om tenester frå kontor for kliniske behandlingsstudiar (KKBS)
Dersom det er behov for samarbeidsavtale med sjukhusapoteket SAV), skal du ta kontakt med Vesna T. Lien (SAV Førde), e-post: vesna.tanaskovic.lien@sav.no og Oddgeir Selaas (SAV Bergen) e-post: oddgeir.selaas@sav.no
Lokal hovudutprøvar (PI) er ansvarleg for kontrakts-prosessen med oppdragsgjevar (sponsor), her under kvalitetssikring av kontrakten og forhandling med oppdragsgjevar om betaling og andre betingelsar.
I bidragsstudiar kan koordinator for kliniske studiar bistå PI i dette arbeidet.
I oppdragsstudiar bistår Regional forskingsstøtte i Helse Bergen med å opprette budsjett og forhandle kontrakten med sponsor. Koordinator for kliniske studiar hjelper deg med å opprette kontakt med regional forskingsstøtte.
Sjå Kliniske studiar på oppdrag for industri - prosess og forankring
Samarbeidsavtalen er ein to-parts avtale som skal signerast av:
- Sponsor, eller CRO, på vegne av Sponsor
- HFD ved klinikkdirektør
- PI signerer avtalen som «lest og forstått»
Når alt er på plass, fyller du ut «Sjekkliste for kliniske studiar i Helse Førde».
Sjekklista skal signerast av PI og klinikkdirektør.
Når sjekklista er signert, kan ein gje beskjed til sponsor om at ein er klar til monitorering.
Signert sjekkliste skal arkiverast i Elements.
Sponsor arrangerer oppstartsmøte for PI, forskings-/studiesjukepleiarar og andre som skal vere involvert i studien ved kvart studiesenter.
Sponsor er ansvarleg for å belyse vitskapleg bakgrunn for studien og kva som vert testa, gje ein grundig gjennomgang av studieprosedyrane, samt forventa biverknader og behandling av disse.
PI er ansvarleg for å kalle inn studiepersonale ved avdelinga og ved samarbeidsavdelingane. Koordinator for kliniske studiar kan hjelpe til med dette.
I forbindelse med oppstartsmøtet er det vanleg at sponsor utleverer studiepermar, Investigator Site File (ISF). Det er anbefalt at ein gjer seg kjent med inndelinga i permane og begynner å legge inn dokument heilt frå starten av studien. ISF skal vere oppdatert til ei kvar tid i forbindelse med monitorering eller audit (kontrollbesøk) frå sponsor, men også fordi myndigheitene kan kome på inspeksjonsbesøk på kort varsel.
Monitor skal gjere besøk på senter før oppstart (initieringsmøte), undervegs og ved studieslutt (avsluttande monitorering). Monitor skriv rapport etter besøk og sender denne til PI og sponsor, og følger opp senter med lukking av evt funn.
Initieringsmøte med monitor
Før ein kan gå i gang med studien skal ein gjennomføre initieringsmøte med monitor. Det er tilstrekkelig at PI og studiesjukepleiar er med i dette møtet.
Her går ein gjennom studiepermen (ISF) og sjekker at alt som krevst er på plass. Før monitor kjem på initieringsvisitt er det lurt å:
- Sjekke om alt studiepersonell har fått opplæring, gjennomført eventuelle e-læringsprogram, og at dei har fått tilgang og opplæring i e-CRF.
- Samle inn GCP-bevis og oppdaterte CV-ar frå personale som er involvert i studien. Disse skal vere datert og signert.
- Bestemme kva som er kjeldedata og kor disse finnes (DIPS, lab-ark, dagbøker etc.)
Etter møtet får PI tilsendt ein rapport. Dersom det er oppgåver som må gjerast, skal ein sende melding til monitor når disse et utført.
Monitor gir beskjed til PI om at ein kan starte studien når alt er klart (= Grønt lys)
Monitorering undervegs i studien:
- Sjekke samtykker
- Vert deltakarane inkludert i samsvar med protokollen?
- Følger senteret prosedyrene i studien?
- Sjekke datainnsamling, vert dette utført korrekt, er data korrekt, følgast protokollen?
- Sjekke studiearkiv på senter: har dei siste versjon av viktige dokument? Er arkivet komplett?
- Brukast det medisinske utstyret i henhold til protokollen?
- Meldast hendelser (AE/SAE) etter prosedyren?
Avsluttande monitorering
- Går gjennom studiepermen, sjekker at alle essensielle dokument er på plass og at sponsor har mottatt alle dokument som skal lagrast i TMF (trial master file).
- Sende sluttrapport.
Tilgang til pasientjournal
Prosessen med å gje eksterne monitorar elektronisk tilgang til pasientjournalen er omfattande. Monitorar som arbeider ved regional forskingsstøtte i Helse Bergen, kan inngå null-kontrakt med Helse Førde og søkje om tilgang til DIPS. Her loggfører monitor journalinnsyn i forbindelse med monitoreringsbesøk.
Der monitor ikkje har tilgang til DIPS, skriv PI/studiesjukepleiaren ut dei notata frå pasientjournalen som er aktuelle for studien før kvart monitorbesøk. Utskriftene frå journalen skal oppbevarast i pasientens studieperm og makulerast umiddelbart etter at pasienten avsluttar studien. Det er viktig å presisere overfor sponsor at utskrifter frå journalen er eit augeblikksbilete og ikkje i seg sjølv kan reknast som kjeldedata då kjelda alltid vil vere Helse Førde sitt elektroniske journalsystem.
Når alle registreringar og godkjenningar er på plass, samarbeidsavtalen er signert og sponsor/monitor har gitt klarsignal, kan studien starte.
Følgande vert anbefalt å gjere før ein startar inkludering av pasientar:
- Lage eit flytskjema med alle studieprosedyrar (t.d. i Excel) for å planlegge studieforløpet for kvar enkelt pasient
- Sjekke om alt nødvendig utstyr er på plass (laboratorieutstyr, EKG- maskin etc.)
- Sjekke når studiemedisin vert tilgjengelig og retningsliner for oppbevaring
Før oppstart
Lokal hovedutprøvar (PI) skal opprette mappe i Elements.
Namn mappe: FOI + Prosjekttittel.
Her skal ein dokumentere og arkivere REK-godkjenning, forskingsprotokoll, samtykkeskriv, avtalar og andre viktige dokument i studien.
Avslutning
Studien vert rekna som avslutta når siste pasient er ute av studien ved alle sentre, alle data er samla inn og sponsor har gitt beskjed om at dei ikkje har fleire spørsmål.
PI har ansvar for at alle essensielle dokument vert arkivert i Investigator Site File (ISF) og at dette vert arkivert i fjernarkivet eller i mappe på HV forskingsservar. Oversikt over kvar dokumenta er lagra skal arkiverast i Elements.
For kliniske legemiddelutprøvingar er kravet til oppbevaring av essensielle dokument minimum 15 år, studiar som er godkjet etter nytt regelverk skal lagrast i 25 år, etter at studien er avslutta ved alle senter.
Etter endt lagringstid skal dokumenta enten anonymiserast (kodeliste og samtykke skal destruerast) eller makulerast.
For utprøving av medisinsk utstyr er kravet om oppbevaring 15 år ved studiar der medisinske utstyr er eit implantat og 5 år for studiar der medisinsk utstyr ikkje er eit implantat.
PI har ansvar for arkivering og for å destruerer dokumenta.
Roller, ansvar og oppgåver i forskingsprosjekt
Roller og ansvar i kliniske legemiddelutprøvingar og utprøving av medisinsk utstyr
Kliniske studiar på oppdrag frå industri - prosess og forankring
Kliniske oppdragsstudiar - rutine for økonomi-oppfølgjing
Forskings-/studiesjukepleiar - rollebeskriving
Innsamling, bruk, utlevering og oppbevaring av personopplysingar
Sjekkliste for kliniske studiar
Mal - Førespurnad om internt samarbeid i klinisk studie
Mal - søknad om laboratorietenester
Mal - søknad om tenester ved Kontor for kliniske behandlingsstudiar